ของแข็ง ของเหลว และก๊าซ
ก๊าซ
ความสัมพันธ์ระหว่างอุณหภูมิ ความดัน และปริมาตรของแก๊ส
- ปริมาตร ความดัน และอุณหภูมิของแก๊ส มีความสัมพันธ์กันอย่างไร
(แก๊สต่างๆ นั้นจะมีความสัมพันธ์ระหว่าง ปริมาตร ความดัน และอุณหภูมิ อย่างใกล้ชิด โดยความสัมพันธ์จะแบ่งเป็นคู่ความสัมพันธ์ เมื่อให้ปริมาตรของแก๊สคงที่ตลอดการพิจารณา)
1) ปริมาตร- ความดัน ความสัมพันธ์นี้เสนอโดย รอเบิร์ต บอยล์ (Robert Boyle, 1662) กล่าวไว้ว่า “ เมื่ออุณหภูมิและจำนวนอนุภาคคงที่ ปริมาตรของแก๊สใดๆ จะแปรผกผันกับความดันของแก๊สนั้นๆ” ดังสมการ
![]() หรือ
หรือ ![]()
ดังนั้น PV = k
เมื่อ V คือ ปริมาตร
P คือ ความดัน
k คือ ค่าคงที่
2) อุณหภูมิ- ปริมาตร ความสัมพันธ์นี้ค้นพบโดย ชาร์ล (Jacques Charles, 1787) ที่กล่าวไว้ว่า “ เมื่อความดันและจำนวนอนุภาคคงที่ ปริมาตรของแก๊สใดๆ จะแปรผันตรงกับอุณหภูมิ เคลวิน” ดังสมการ
![]() หรือ V
= kT
หรือ V
= kT
ดังนั้น ![]()
![]()
เมื่อ V คือ ปริมาตร
P คือ ความดัน
k คือ ค่าคงที่
3) อุณหภูมิ- ความดัน ความสัมพันธ์นี้ค้นพบโดย เกย์ - ลุสแซก (Joseph-Louis Gay-Lussac, 1802) ที่กล่าวไว้ว่า “ เมื่อปริมาตร และจำนวนอนุภาคคงที่ ความดันของแก๊สใดๆ จะแปรผันตรงกับอุณหภูมิเคลวิน” ดังสมการ
![]() หรือ P
= kT
หรือ P
= kT
ดังนั้น ![]()
เมื่อ P คือ ความดัน
T คือ อุณหภูมิ
k คือ ค่าคงที่
จากกฎทั้งสาม เมื่อนำมารวมกันจะนำไปสู่กฎรวมของแก๊ส นั่นคือ
ดังนั้น ![]()
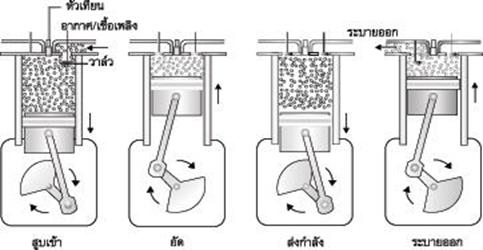
(การทำงานของลูกสูบ เริ่มจากการปล่อยให้ไอของเชื้อเพลิงไหลเข้าไปในกระบอกสูบ เมื่อกระบอกสูบอัดตัวเข้ามา หัวเทียนก็จะจุดระเบิดเชื้อเพลิงได้เป็นแก๊สคาร์บอนไดออกไซด์ และไอน้ำออกมาเป็นผลิตภัณฑ์ที่อุณหภูมิสูง ดังนั้นปริมาตรของกระบอกสูบก็จะขยายออกอีกครั้ง หลังจากนั้นจึงมีการระบายแก๊สออกไปยังท่อไอเสีย การทำงานที่สัมพันธ์กันนี้ เมื่อกระบอกสูบหดและขยายตัวสลับกันไป ก็จะทำให้ก้านสูบไปดันให้เกิดการหมุนของล้อและเพลาได้อย่างต่อเนื่อง)
สรุปทฤษฎีต่างๆ ของก๊าซ
![]()
เมื่อ T และ คงที่
P 1V 1 = P 2V 2
![]()
เมื่อ P และ nคงที่
![]()
![]()
เมื่อ V และ n คงที่
![]()
กฎของก๊าซ สมบัติของแก๊สที่ได้จากการทดลองของนักวิทยาศาสตร์ทั้งสาม คือ บอยล์ ชาร์ล และเกย์-ลูสแซก นำมารวมกันเป็นกฎของแก๊ส จะได้กฎของแก๊ส คือ
![]() (เมื่อปริมาณหรือจำนวนโมเลกุลของแก๊สคงที่)
(เมื่อปริมาณหรือจำนวนโมเลกุลของแก๊สคงที่)
และจะได้
![]()
จากความสัมพันธ์ ข้างต้นแสดงให้เห็นว่า ![]() เป็นค่าคงที่
ซึ่งค่าคงที่ตัวนี้ขึ้นอยู่กับจำนวนโมเลกุลของแก๊สในภาชนะ (N) ทีใช้ทดลอง คือ
ถ้าจำนวนโมเลกุลเปลี่ยนไปค่า
เป็นค่าคงที่
ซึ่งค่าคงที่ตัวนี้ขึ้นอยู่กับจำนวนโมเลกุลของแก๊สในภาชนะ (N) ทีใช้ทดลอง คือ
ถ้าจำนวนโมเลกุลเปลี่ยนไปค่า ![]() ต้องเปลี่ยนไปด้วย เช่น
การรั่วของแก๊สจากลูกโป่งทำให้ปริมาตรของลูกโป่งลดลง
และความดันภายในลูกโป่งลดลงด้วย
ต้องเปลี่ยนไปด้วย เช่น
การรั่วของแก๊สจากลูกโป่งทำให้ปริมาตรของลูกโป่งลดลง
และความดันภายในลูกโป่งลดลงด้วย
ให้ N เป็นจำนวนโมเลกุลของแก๊สในภาชนะ
ดังนั้น ![]()
![]()
หรือ
![]()
เมื่อ KB คือ ค่าคงตัวของโลต์ซมัน์ (Boltzmann’s constant ) มีค่าเท่ากับ 1.38x10 -23 จูลต่อเคลวิน
ให้ n เป็นจำนวนโมลของก๊าซในภาชนะ
เนื่องจาก n = มวลของก๊าซ (m) / มวลโมเลกุลของแก๊ส (M)
หรือ
![]()
เมื่อ N A คือ เลขอาโวกาโดร (Avogadro’s number) มีค่าเท่ากับ 6.02x10 23 โมเลกุลต่อโมล
จะได้
![]()
หรือ PV = nRT
ดังนั้นสูตรที่เกี่ยวข้องกับโมลของแก๊ส PV = nRT
เมื่อ R= N AK B
มีค่าเท่ากับ 8.314 จูลต่อโมล-เคลวิน เรียกว่า ค่าคงตัวของแก๊ส
ตัวอย่างที่ 1 5 อากาศซึ่งอยู่ในห้องที่มีขนาด 50 ลูกบาศก์ อุณหภูมิเพิ่มขึ้นจาก 0 องศาเซลเซียสเป็น 27 องศาเซลเซียส จงหาว่าอากาศจะรั่วออกไปจากห้องกี่กิโลกรัม กำหนดความหนาแน่นของอากาศที่ 0 องศาเซลเซียสเท่ากับ 1.3 กิโลกรัมต่อลูกบาศก์เมตร
วิธีทำ จากกฎของแก๊ส ![]()
ในที่นี้ความดันของอากาศในห้องต้องคงตัว จะได้
p 1 T 1 = p 2 T 2
p 2 = ( 1.3x273)/300
= 1.18 kg/m 3
มวลของอากาศที่รั่วออกไปจากห้อง = m 1-m 2= ( p 1 - p 2 ) V = (1.3
– 1.18)50
= 5.85 kg.
ดังนั้น อากาศจะรั่วออกไปจากห้องเท่ากับ 5.85 กิโลกรัม
ตอบ
P t = P 1 + P 2 + P 3 + P 4 + ……..
P t = ความดันรวมของก๊าซผสม
พลังงานจลน์เฉลี่ย = 1/2 mv 2
= 3/2 kT
k = ค่าคงที่ของ Botzman
=
1.39 X 10 -23 J/K.mol
การแพร่ของแก๊ส
เรื่องการแพร่ของแก๊สนี้สามารถแสดงให้เห็นได้ง่ายๆ โดยอาศัยแก๊สที่มีสี อาจจะใช้เกล็ดไอโอดีนให้ระเหิดและกระจายตัวออกไปก็ได้ เพื่อให้นักเรียนได้เห็นถึงการเคลื่อนที่ของแก๊สว่ามี ทิศทางอย่างไร ได้อย่างชัดเจน และเข้าใจได้มากขึ้น หรืออาจทดลองได้ง่ายๆ โดยใช้สารละลาย แอมโมเนียเข้มข้น (conc NH 3) กับสารละลาย กรดไฮโดรคลอริกเข้มข้น (conc HCl) โดยใช้ไม้พันสำลีชุบสารละลายแอมโมเนียเข้มข้น และไม้พันสำลีชุบสารละลายกรดไฮโดรคลอริก เข้มข้น นำไม้พันสำลีทั้งสองไปปิดที่ปลายของหลอดแก้วปลายเปิดทั้งสองด้าน ดังภาพ
สารละลายกรด ไฮโดรคลอริก (HCI ) |
||
เกลือแอมโมเนียคลอไรด์ สารละลายกรดแอมโมเนีย (NH 4CI ) (NH 3 ) |
||
การทดลองเรื่องการแพร่ของแก๊ส |
||
เนื่องจากทั้งสารละลายแอมโมเนียเข้มข้นและสารละลายกรดไฮโดรคลอริกเข้มข้นกลายเป็น
ไอได้ง่าย ( ไอแอมโมเนียและไอไฮโดรเจนคลอไรด์)
ไอที่เกิดขึ้นจะแพร่ไปตามหลอดแก้ว เมื่อไอทั้งสองสัมผัสกัน
ก็จะเกิดปฏิกิริยากลายเป็นแอมโมเนียมคลอไรด์ ซึ่งสังเกตได้เพราะเป็นของแข็งสีขาว
แล้ววัดระยะของของแข็งจะพบว่าแก๊สแอมโมเนียแพร่มาได้ไกลกว่า
เนื่องจากมวลโมเลกุลน้อยกว่านั่นเอง ( มวลโมเลกุลของแอมโมเนีย คือ 17
และมวลโมเลกุลของกรดไฮโดรคลอริก คือ 36.5)
![]() หรือ
หรือ
![]()
r = อัตราการแพร่ของก๊าซ
M = มวลโมเลกุลของก๊าซ
D = ความหนาแน่นของก๊าซ
หน่วยต่าง ๆ ที่เกี่ยวกับก๊าซ
ปริมาตร 1 ลิตร = 1 dm 3
= 1000 มิลลิลิตร
= 1000 CC.
= 1000 cm3
ความดัน 1 บรรยากาศ = 760 มม. ปรอท
= 76 ซม. ปรอท
= 760 ทอร์
= 14.7 ปอนด์/ ตารางนิ้ว
ความดันย่อยของแก๊สผสม
ความดันของแก๊สผสม ย่อมเกิดจากความดันย่อยของแก๊สแต่ละชนิด อาจจะยกตัวอย่างให้เห็นได้ง่ายๆ โดยอาศัยอากาศมาอธิบาย เนื่องจากอากาศเองก็มีความดัน และองค์ประกอบของอากาศก็มีมากมายอันได้แก่ แก๊สชนิดต่างๆ เช่น ไนโตรเจน ออกซิเจน คาร์บอนไดออกไซด์ เป็นต้น
ตาราง ร้อยละของแก๊สองค์ประกอบในบรรยากาศโลก
|
แก๊ส |
ร้อยละโดยปริมาตรของแก๊สองค์ประกอบในบรรยากาศโลก |
ไนโตรเจน ( N2 ) |
78.80 |
ความดันบรรยากาศ เกิดจากความดันย่อยของแก๊สแต่ละชนิดรวมกันนั่นเอง
ของเหลว
สมบัติของเหลว
1. ของเหลวมีปริมาตรคงที่ แต่รูปร่างไม่คงที่
2. แรงยึดเหนี่ยวระหว่างโมเลกุลมากกว่าก๊าซแต่น้อยกว่าของแข็ง
3. การแพร่จะช้ากว่าก๊าซ แต่เร็วกว่าของแข็ง
4. ความหนาแน่นมากกว่าก๊าซ แต่น้อยกว่าของแข็ง
5. เมื่อนํามาผสมกัน ปริมาตรก่อนและหลังอาจเท่าหรือไม่เท่ากันก็ได้
6. ปริมาตรจะเปลี่ยนแปลงไปน้อยเมื่ออุณหภูมิและความดันเปลี่ยน
การระเหย จะเกิดบริเวณผิวหน้าของเหลว เนื่องจากโมเลกุลบริเวณนั้นมีพลังงานสูงพอที่จะเอาชนะแรงยึดเหนี่ยวระหว่างโมเลกุลจึงหลุดกลายเป็นไอ
จุดเดือด เป็นอุณหภูมิที่ของเหลวเปลี่ยนสถานะกลายเป็นไอ ขณะนั้นความดันไอของเหลวต้องเท่ากับความดันบรรยากาศ
ความดันไอ จะเกิดในขณะของเหลวกลายเป็นไอ จะมากน้อยขึ้นอยู่กับ
1. ชนิดของของเหลว
2. อุณหภูมิของเหลว
3. พื้นที่ผิว
จุดเดือดของเหลว ![]() P บรรยากาศ
P บรรยากาศ
![]() 1/P ไอของเหลว
1/P ไอของเหลว
สมดุลไดนามิก มักเป็นภาวะสมดุลของของเหลวที่จะมีอัตราการเกิดปฏิกิริยาไปข้างหน้าเท่ากับอัตราการเกิดปฏิกิริยาย้อนกลับ
แรงยึดเหนี่ยวระหว่างโมเลกุลของของเหลว มีผลต่อสมบัติที่สำคัญของของเหลวนั้น ได้แก่ แรงตึงผิว (Surface tension) และความหนาแน่น (Density) ถ้าโมเลกุลของของเหลวนั้นมีแรงยึดเหนี่ยวซึ่งกันและกันมาก ก็จะทำให้ความหนาแน่นและแรงตึงผิวของของเหลวนั้นมีค่าสูง เพราะโมเลกุลสามารถถูกดึงดูดให้อยู่ใกล้ชิดกันได้มาก นอกจากนั้น เมื่อความหนาแน่นและแรงตึงผิวมี ค่ามาก จะทำให้ของเหลวนั้นมีความหนืด (Viscosity) สูง
ค่าความหนาแน่น ความหนืด และแรงตึงผิวนี้ จะขึ้นอยู่กับอุณหภูมิ โดยจะแปรผกผันกับอุณหภูมิ เนื่องจากอุณหภูมิที่สูงขึ้นจะทำให้โมเลกุลแต่ละโมเลกุลมีพลังงานสูงขึ้น สามารถเคลื่อนที่ไปมาได้อย่างอิสระมากขึ้น ทำให้โมเลกุลขยับออกห่างจากกันมากขึ้นไปด้วย ด้วยเหตุนี้ความหนาแน่น ความหนืด และแรงตึงผิวของของเหลวนั้นจึงลดลง นอกจากนี้ เรายังสามารถลดแรงตึงผิวของของเหลวได้โดยการเติมสารลดแรงตึงผิวลงไปในของเหลวนั้น ตัวอย่างเช่น น้ำสบู่ ผงซักฟอก น้ำยาล้างจาน เป็นต้น
เมื่อพิจารณาถึงโมเลกุลในภาชนะ โมเลกุลของของเหลวจะมีแรงยึดเหนี่ยวกันระหว่างโมเลกุลในทุกทิศทุกทาง แต่โมเลกุลที่อยู่บริเวณผิวหน้าของของเหลวจะมีแรงยึดเหนี่ยวกับโมเลกุล ด้านข้างและด้านล่างเท่านั้น แรงยึดเหนี่ยวจากด้านบนนั้นไม่มี แรงที่ดึงผิวหน้าของของเหลวเข้ามาภายในนี้จะเรียกว่า แรงตึงผิว โดยสังเกตได้จากเมื่อใส่น้ำในกระบอกตวง ผิวหน้าของน้ำจะมีลักษณะโค้งลง หรือหยดน้ำบนใบบัว หรือบนแผ่นกระจกจะมีลักษณะเป็นทรงกลมหรือทรงรีก็เพราะแรงตึงผิวของ
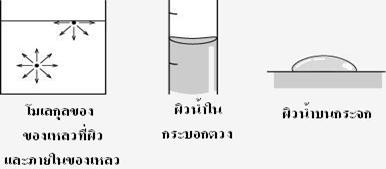
น้ำจะพยายามดึงผิวของของเหลวเข้ามาทุกทิศทาง และทรงกลมจะเป็นรูปที่มีพื้นที่ผิวน้อยที่สุดนั่นเอง
ของแข็ง
- ของแข็งจับยึดกันได้อย่างแข็งแรง เป็นสถานะที่โมเลกุลเคลื่อนที่ได้น้อยที่สุด ลักษณะการจัดเรียงตัวของโมเลกุลของของแข็งน่าจะเป็นอย่างไร มีระเบียบมากหรือน้อยกว่าสถานะอื่นๆ อย่างไร
(การจัดเรียงตัวของโมเลกุลในสถานะของแข็งนั้นจะแน่นหนา และแข็งแรงกว่าสถานะอื่นๆ จึงทำให้ของแข็งสามารถคงรูปร่างไว้ได้ โดยไม่ไหล หรือเปลี่ยนรูปร่างไปมาได้โดยง่ายเหมือนของเหลว และแก๊ส)
* ของแข็งอสัณฐาน คือ ของแข็งที่อนุภาคจัดเรียงอย่างไม่เป็นระเบียบ
* ผลึก คือ ของแข็งที่อนุภาคจัดเรียงตัวอย่างเป็นระเบียบ
ดังนั้นอาจจะแยกของแข็งที่เป็นระเบียบและไม่เป็นระเบียบออกจากกัน
 .........................................
.........................................
โครงสร้างผลึกของ C 60..........................................ท่อคาร์บอนที่มีผนังหลายชั้น
นอกจากนี้ของแข็งชนิดอื่นๆ ก็สามารถพบว่ามีอัญรูปได้เช่นเดียวกัน เช่น กำมะถัน หรือฟอสฟอรัส เป็นต้น ลองค้นคว้าหาอัญรูปแบบอื่นๆ ของของแข็งชนิดต่างๆ ดู
กำมะถันนั้นมีรูปแบบที่เป็นผลึกอยู่ 2 แบบด้วยกัน คือ กำมะถันแอลฟา และกำมะถันบีตา ซึ่งเกิดจากการจัดเรียงตัวที่ต่างกัน ส่งผลให้มีคุณสมบัติบางประการไม่เหมือนกันด้วย เช่น สี จุด หลอมเหลว ความหนาแน่น
หนึ่งโมเลกุลของกำมะถัน ประกอบด้วย 8 อะตอมต่อกันเป็นวง โดยกำมะถันที่เป็นผลึกจะมีอยู่ 2 อัญรูป คือ
1) กำมะถันแอลฟา หรือกำมะถันรอมบิก (Rhombic sulphur) ผลึกจะมีลักษณะเป็นรูป สี่เหลี่ยม
2) กำมะถันบีตา หรือกำมะถันมอนอคลินิก (Monoclinic sulphur) ผลึกจะมีลักษณะเป็นรูปเข็ม
ซึ่งผลึกทั้ง 2 อัญรูปนี้จะมีสมบัติที่แตกต่างกัน คือ
ตาราง สมบัติบางประการของกำมะถันรอมบิกและกำมะถันมอนอคลินิก
|
สมบัติ |
กำมะถันรอมบิก |
กำมะถันมอนอคลินิก |
|
รูปผลึก |
เหลี่ยม |
เข็ม |
|
สี |
เหลืองอ่อน |
เหลืองเข้ม |
|
ความหนาแน่นจุด |
2.07 กรัม/cm 3 |
1.96 กรัม/cm 3 |
|
หลอมเหลว |
112.8 ๐C |
119 ๐C |
|
จุดเดือด |
444.6 ๐C |
444.6 ๐C |
|
การนำไฟฟ้า |
ไม่นำไฟฟ้า |
ไม่นำไฟฟ้า |
ผลึกฟอสฟอรัสนั้นพบอยู่ 3 แบบ คือ ฟอสฟอรัสขาว ฟอสฟอรัสแดง และฟอสฟอรัสดำ
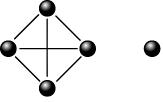
- ฟอสฟอรัสขาว หรือฟอสฟอรัสเหลือง ประกอบด้วยฟอสฟอรัส 4 อะตอม มีสูตรโมเลกุล P 4
- ฟอสฟอรัสแดง มีโครงสร้างเป็นสายยาวต่อกันไป
- ฟอสฟอรัสดำ มีโครงสร้างแบบโครงผลึกร่างตาข่าย
ตาราง สมบัติบางประการของฟอสฟอรัสขาว แดง และดำ
|
สมบัติ |
ฟอสฟอรัสขาว |
ฟอสฟอรัสแดง |
ฟอสฟอรัสดำ |
|
ลักษณะ |
ของแข็งสีขาว หรือเหลือง |
ของแข็งสีแดง |
ของแข็งสีดำ |
|
จุดหลอมเหลว |
44 ๐C |
590 ๐C ( ที่ความดันสูง) |
610 ๐C |
|
ความหนาแน่น |
1.82 กรัม/cm 3 |
2.34 กรัม/cm 3 |
2.70 กรัม/cm 3 |
|
การนำไฟฟ้า |
ไม่นำไฟฟ้า |
ไม่นำไฟฟ้า |
นำไฟฟ้าเล็กน้อยที่อุณหภูมิสูง |