สถานะของสารและการเปลี่ยนแปลง
สถานะของสารสามารถแบ่งออกเป็น 3 สถานะ คือ
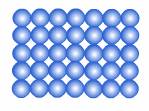
1. ของแข็ง (solid) คือ สารที่มีรูปร่างและปริมาตรที่แน่นอน ไม่เปลี่ยนแปลงตามภาชนะ อนุภาคชิดกันเป็นระเบียบ มีความหนาแน่นและแรงยึดเหนี่ยวระหว่างโมเลกุลสูงกว่าของเหลวและก๊าซ

ภาพแสดงการจัดเรียงอนุภาคของของแข็ง
2. ของเหลว (liquid) คือ สารที่มีปริมาตรแน่นอน แต่มีรูปร่างไม่แน่นอนเปลี่ยนแปลงตามภาชนะที่บรรจุ อนุภาคอยู่ใกล้เคียงกันแต่ไม่เป็นระเบียบ มีการชนกันตลอดเวลา จึงมีความหนาแน่นสูงกว่าก๊าซ
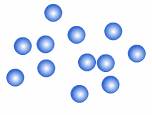
ภาพแสดงการจัดเรียงอนุภาคของของเหลว
3. ก๊าซ (gas) คือ สารที่มีรูปร่างและปริมาตรไม่แน่นอน เปลี่ยนแปลงตามภาชนะที่บรรจุเพราะมีแรงยึดเหนี่ยวระหว่างโมเลกุลน้อยมาก จึงฟุ้งกระจายได้เต็มภาชนะและมีความหนาแน่นต่ำ
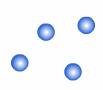

ภาพแสดงการจัดเรียงอนุภาคของก๊าซ
ระบบและการเปลี่ยนแปลงของสาร
ระบบ (system) หมายถึง สิ่งที่อยู่ภายในขอบเขตที่ต้องการศึกษา การกำหนดองค์ประกอบของระบบ ขึ้นอยู่กับจุดมุ่งหมายของการศึกษา ซึ่งต้องกำหนดหรือระบุให้ชัดเจน
สิ่งแวดล้อม (environment) หมายถึง สิ่งต่างๆ ที่อยู่นอกขอบเขตที่ต้องการศึกษา ตัวอย่างการกำหนดองค์ประกอบของระบบ เช่น การศึกษาการละลายของน้ำตาลทรายในน้ำ โดยสารละลายน้ำตาลทรายจะเป็นระบบ ส่วนบีกเกอร์ ภาชนะ และแท่งแก้วจัดเป็นสิ่งแวดล้อม
ภาวะของระบบ หมายถึง สมบัติต่าง ๆ ของสาร และปัจจัยที่มีผลต่อสมบัติของระบบ เช่น ความดันบรรยากาศ อุณหภูมิ ปริมาณของสาร เมื่อระบบเกิดการเปลี่ยนแปลงแล้วจะมีการถ่ายเทพลังงานระหว่างระบบกับสิ่งแวดล้อม ดังนี้
ก. ระบบที่มีการเปลี่ยนแปลงประเภทคายความร้อน คือ ระบบที่เมื่อเกิดการเปลี่ยนแปลงแล้ว ระบบจะถ่ายเทความร้อนให้แก่สิ่งแวดล้อม ทำให้สิ่งแวดล้อมร้อนขึ้น
ข. ระบบที่มีการเปลี่ยนแปลงประเภทดูดความร้อน คือ ระบบที่เมื่อเกิดการเปลี่ยนแปลงแล้ว ระบบจะดูดความร้อนจะสิ่งแวดล้อมทำให้สิ่งแวดล้อมนั้นเย็นลง
ประเภทของระบบ
การเปลี่ยนแปลงพลังงานระหว่างระบบและสิ่งแวดล้อม จะใช้การถ่ายเทมวลของสารเป็นเกณฑ์ในการแบ่งประเภทของระบบ ดังนี้
- ระบบเปิด (open system) หมายถึง ระบบที่มีการถ่ายเทมวลให้กับสิ่งแวดล้อม
- ระบบปิด (close system) หมายถึง ระบบที่ไม่มีการถ่ายเทมวลให้กับสิ่งแวดล้อม
- ระบบโดดเดี่ยว ( lone system) หมายถึง ระบบที่ไม่มีการถ่ายเทมวลและพลังงานให้กับสิ่งแวดล้อม

ระบบเปิด...................ระบบปิด...................ระบบโดดเดี่ยว
การเปลี่ยนแปลงพลังงานของระบบ
การเปลี่ยนแปลงพลังงานของระบบมี 2 ประเภท คือ
1. การเปลี่ยนแปลงประเภทคายความร้อนหรือประเภทคายพลังงาน คือ การเปลี่ยนแปลงที่ระบบคายพลังงานให้แก่สิ่งแวดล้อม เนื่องจากระบบมีอุณหภูมิสูงกว่าสิ่งแวดล้อม จึงถ่ายเทพลังงานจากระบบไปสู่สิ่งแวดล้อม เช่น การละลายของโซดาไฟในน้ำ อุณหภูมิของสารละลายสูงขึ้น จึงถ่ายเทพลังงานให้กับสิ่งแวดล้อม เพื่อทำให้อุณหภูมิของระบบลดลงจนอุณหภูมิของระบบเท่ากับอุณหภูมิของสิ่งแวดล้อม ดังภาพ
2. การเปลี่ยนแปลงประเภทดูดความร้อนหรือประเภทดูดพลังงาน คือ การเปลี่ยนแปลงที่ระบบดูดพลังงานจากสิ่งแวดล้อม เนื่องจากระบบมีอุณหภูมิต่ำกว่าสิ่งแวดล้อม ระบบจะปรับตัวโดยดูดพลังงานความร้อนจากสิ่งแวดล้อมเข้าสู่ระบบ เพื่อทำให้อุณหภูมิของระบบเท่ากับอุณหภูมิของสิ่งแวดล้อม เช่น การละลายของเกลือแกงในน้ำ อุณหภูมิของสารละลายต่ำลง จึงดูดพลังงานเข้าสู่ระบบ เพื่อทำให้อุณหภูมิของระบบสูงขึ้นจนอุณหภูมิของระบบเท่ากับอุณหภูมิของสิ่งแวดล้อม
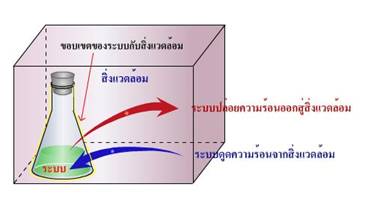
ภาพแสดงการ เปลี่ยนแปลงพลังงานของระบบ
การเปลี่ยนสถานะของสาร
สารต่างๆ อาจอยู่ในสถานะก๊าซ ของเหลว หรือของแข็งก็ได้ ขึ้นอยู่กับชนิดของสาร สารแต่ละชนิดจะมีจุดเดือดและจุดหลอมเหลวต่างกัน ซึ่งเป็นคุณสมบัติเฉพาะตัวของสาร การเปลี่ยนแปลงอุณหภูมิจะมีผลต่อการเปลี่ยนแปลงสถานะของสาร โดยที่พิจารณาตามหลักการ ดังภาพ
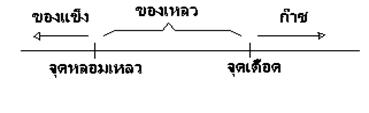
- การเปลี่ยนแปลงของสารจากสถานะของแข็งเป็นของเหลว เรียกว่า
การหลอมเหลว อุณหภูมิขณะนั้นจะคงที่เรียนกว่า จุดหลอมเหลว
- การเปลี่ยนสถานนะของสารจากของเหลวกลายเป็นไอ เรียกว่า
การเดือด อุณหภูมิขณะนั้นจะคงที่เรียกว่า จุดเดือด
พลังงานกับการเปลี่ยนแปลงของระบบ
การเปลี่ยนแปลงของสารมี 3 ลักษณะ คือ การเปลี่ยนสถานะ , การละลาย และการเกิดปฏิกิริยาเคมี โดยการเปลี่ยนแปลงของสารจะ เกี่ยวข้องกับพลังงานดังต่อไปนี้
1. พลังงานกับการเปลี่ยนสถานะ สารมี 3 ลักษณะ คือ ของแข็ง , ของเหลว และก๊าซ
เมื่อสารเปลี่ยนสถานะจากของแข็งเป็นของเหลว หรือของเหลวเป็นก๊าซ หรือของแข็งเป็นก๊าซจะต้องดูดความร้อนจากสิ่งแวดล้อม ถ้าสารเปลี่ยนสถานะจากก๊าซเป็นของเหลว หรือของเหลวเป็นของแข็ง หรือก๊าซเป็นของแข็งจะต้องคายความร้อนให้กับสิ่งแวดล้อมขณะที่สาร เปลี่ยนสถานะ อุณหภูมิของสารจะไม่เปลี่ยนแปลงแม้ว่าจะดูดความร้อนตลอดเวลา เพราะความร้อนถูกใช้ในการเปลี่ยนสถานะ ปริมาณความ ร้อนที่ใช้ในการเปลี่ยนสถานะเรียกว่า " ความร้อนแฝง " ความร้อนแฝงจะมีหลายชนิดขึ้นอยู่กับสถานะของสาร
2. พลังงานกับการละลายในการละลายเกิดจากสารตั้งแต่ 2 ชนิดขึ้นไปมาผสมเป็นเนื้อเดียวกันโดยไม่เกิดปฏิกิริยา
เมื่อสารเกิดการละลายจะเกี่ยวข้องกับพลังงานทุกขั้น การละลายมี 2 ขั้นตอน ดังนี้
ก. อนุภาคของแข็งแยกตัวออกเป็นอนุภาคเล็ก ๆ ของแข็งมีจำนวนมากมายอยู่รวมกันโดยมีแรงยึดเหนี่ยวระหว่างกัน การแยกอนุภาคของแข็งออกจากเป็นอนุภาคเล็ก ๆ ต้องใช้พลังงาน (ดูดพลังงานจากสิ่งแวดล้อม) พลังงานนี้เรียกว่า " พลังงานแลตทิซ " (Lattice Energy)
ข. อนุภาคเล็ก ๆ ของของแข็งรวมตัวกับอนุภาคของเหลว เมื่อของแข็งแยกตัวออกเป็นอนุภาคเล็ก ๆ แล้ว อนุภาคเล็ก ๆ เหล่านี้จะกระจาย แทรกตัวอยู่ระหว่างอนุภาคของเหลว ทำให้อนุภาคเล็ก ๆ สร้างแรงยึดเหนี่ยวกับอนุภาคของเหลว การสร้างแรงยึดเหนี่ยวจะเกิดการคายพลังงานซึ่งพลังงานนี้เรียกว่า " พลังงานโซลเวชัน " Solvation Energ ) ถ้าของเหลวที่เป็นตัวทำละลายคือ น้ำ พลังงานนี้เรียกว่า " พลังงานไฮเดรชัน " (Hydration Energy)
ผลการละลายน้ำของสารมีการเปลี่ยนแปลงพลังงานแบบใดจะต้องพิจารณาจากพลังงานแลตทิซ และพลังงานไฮเดรชัน ดังนี้
1. การเปลี่ยนแปลงแบบดูดความร้อน เมื่อพลังงานแลตทิซมากกว่าพลังงานไฮเดรชัน เช่น การละลายน้ำของโพแทสเซียมไนเตรต
2. การเปลี่ยนแปลงแบบคายความร้อน เมื่อพลังงานไฮเดรชันมากกว่าพลังงานแลตทิซ เช่น การละลายน้ำของโซเดียมไฮดรอกไซด์
พลังงานกับการเปลี่ยนแปลงสถานะ
การเปลี่ยนสถานะของสารเป็นการเปลี่ยนแปลงทางกายภาพ การเปลี่ยนสถานะของสารอาจเป็นการเปลี่ยนแปลงประเภทดูดพลังงานหรือคายพลังงาน ดังภาพ
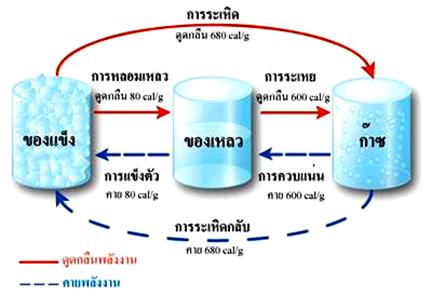
เมื่อสารได้รับความร้อนขณะที่มีการเปลี่ยนสถานะ อุณหภูมิของสารจะไม่มีการเปลี่ยนแปลง โดยจะนำ ความร้อนที่ได้รับไปใช้เปลี่ยนสถานะ ซึ่งเรียกค่าพลังงานที่นำไปใช้ในการเปลี่ยนแปลงของสารว่า ความร้อนแฝงจำเพาะของสาร สารแต่ละชนิดจะมีค่าความร้อนแฝงจำเพาะ 2 ค่าด้วยกัน คือ
1. ค่าความร้อนแฝงจำเพาะของการหลอมเหลว เป็นค่าพลังงานความร้อนที่นำมาใช้เปลี่ยนสถานะจากของแข็งเป็นของเหลว
2. ค่าความร้อนแฝงจำเพาะของการกลายเป็นไอ เป็นค่าพลังงานความร้อนที่นำไปใช้ในการเปลี่ยนสถานะจากของเหลวเป็นไอ
- น้ำมีค่าความร้อนแฝงจำเพาะของการหลอมเหลว 80 แคลอรีต่อกรัม
หมายความว่าในการทำน้ำแข็ง 1 กรัม ให้หลอมเหลวเป็นน้ำ ต้องใช้พลังงานความร้อน 80
แคลอรี
- น้ำมีค่าความร้อนแฝงจำเพาะของการกลายเป็นไอ 600 แคลอรีต่อกรัม
หมายความว่าในการทำน้ำ 1 กรัม อุณหภูมิ 100 องศาเซลเซียส ให้เปลี่ยนเป็นไอน้ำ 1
กรัม อุณหภูมิ 100 องศาเซลเซียส ต้องให้พลังงานความร้อน 600
แคลอรี
พลังงานกับการเกิดปฏิกิริยาเคมี
เมื่อสารเกิดปฏิกิริยาเคมีจะต้องมีสารใหม่เกิดขึ้นทุกครั้ง วิธีพิจารณาสารใหม่ให้สังเกตการเปลี่ยนสี กลิ่น และสิ่งใหม่ที่เกิดขึ้น เช่น ฟองก๊าซ , ตะกอน หรือควัน เป็นต้น การเกิดปฏิกิริยาเคมีจะต้องเกิด 2 ขั้นตอนเหมือนกับการละลายคือ
ขั้นที่ 1 ต้องสลายแรงยึดเหนี่ยวของสารตั้งต้น ( สารเดิม ) ซึ่งจะต้องใช้พลังงาน ( ดูดพลังงาน ) แยกอนุภาคของสารออกจากกัน
ขั้นที่ 2 อนุภาคที่แยกตัวออกมาจะสร้างแรงยึดเหนี่ยวใหม่กับอนุภาคอื่น ซึ่งต้องคายพลังงานออกมาด้วย
ซึ่งปฏิกิริยาเคมีที่พลังงานขั้นที่ 1 มากกว่าขั้นที่ 2 จะเป็นการเปลี่ยนแปลงแบบดูดความร้อน เช่น ปฏิกิริยาระหว่างแอมโมเนียมคลอไรด์ ( NH4Cl ) กับ แคลเซียมไฮดรอกไซด์ ( Ca ( OH )2 ) แต่ถ้าปฏิกิริยาเคมีที่พลังงานขั้นที่ 1 น้อยกว่าขั้นที่ 2 จะเป็นการเปลี่ยนแปลง แบบคายความร้อน เช่น ปฏิกิริยาระหว่างด่างทับทิม ( KMnO4 ) , น้ำตาลทราย และน้ำ ปฏิกิริยาการเผาไหม้เชื้อเพลิง เป็นต้น
การวัดความร้อน (Calorimetry)
: การวัดความร้อนที่เปลี่ยนแปลงของปฏิกิริยาเคมี โดยใช้ “ Calorimeter ”
q = ปริมาณความร้อน ( J )
m = มวล ( g )
s = ความร้อนแฝงจำเพาะ หรือ specific heat ( J / g oC )
C = ความจุความร้อนของสาร หรือ heat capacity ( J / oC )
T = อุณหภูมิที่เปลี่ยนแปลงไป ( T 2 - T 1 ) ( oC )
ตัวอย่าง น้ำ 500 กรัม ร้อนขึ้นจาก 5 0C เป็น 75 0C จงคำนวณปริมาณความร้อนที่น้ำดูดกลืนเข้าไป กำหนดให้ความร้อนจำเพาะของน้ำ = 4.184 J/g 0C
แทนค่า q = ms
T
= (500 g)(4.184 J/g oC)(75 – 5 oC)
= 1 .46 x 10 5 J
= 146 kJ
พลังงานกับการละลาย
การละลาย หมายถึง การที่อนุภาคของสารตั้งตันสองชนิดข้นไปแทรกรวมเป็นเนื้อเดียวกัน เมื่อของแข็งละลายน้ำจะแตกตัวออกเป็นอนุภาคเล็กๆ ในการแตกตัวออกจากกันระบบจะต้องใช้พลังงานจำนวนหนึ่ง ซึ่งระบบต้องดูดพลังงานเพื่อทำให้อนุภาคของของแข็งที่รวมตัวกันอยู่แยกออกจากกัน และเมื่ออนุภาคของของแข็งกระจายแทรกอยู่ระหว่างโมเลกุลของน้ำจะยึดเหนี่ยวกับโมเลกุลของน้ำได้ ระบบจะต้องคายพลังงานออกมาจำนวนหนึ่ง ดังนั้นการละลายของสารชนิดหนึ่งอาจเป็นการเปลี่ยนแปลงประเภทดูดความร้อนหรือคายความร้อน ขึ้นอยู่กับผลต่างของพลังงานที่ใช้แยกอนุภาคของของแข็งกับพลังงานที่คายออกมา เพื่อให้อนุภาคของของแข็งยึดเหนี่ยวกับน้ำ
สารละลาย (solution) เป็นสารเนื้อเดียวที่ประกอบด้วยสารตั้งแต่ 2 ชนิดขึ้นไป สารที่มีปริมาณมากกว่าจัดเป็น ตัวทำละลาย (solvent) ส่วนสารที่มีปริมาณน้อยกว่าจัดเป็น ตัวถูกละลาย (solute)
การละลายของสารในตัวทำละลายชนิดต่างๆ
ในชีวิตประจำวันจะพบว่าน้ำเป็นตัวทำละลายที่ดี จึงนำไปใช้ในกิจกรรมต่างๆ มากมาย แต่ก็มีสารบางชนิดที่ไม่สามารถละลายในน้ำได้ เช่น หมึกแห้ง หรือไขมันที่เปื้อนมากับเสื้อผ้า จึงได้นำของเหลวบางชนิดที่ใช้ละลายสารที่ไม่สามารถละลายในน้ำได้มาเป็นตัวทำละลายแทน เช่น แอลกอฮอล์ เฮกเซน น้ำมันก๊าด น้ำมันเบนซิน เป็นต้น จึงสรุปได้ว่า สารบางชนิดละลายได้ดีในตัวทำละลายชนิดหนึ่ง แต่อาจไม่ละลายในตัวทำละลายชนิดอื่น ดังนั้นการเลือกตัวทำละลายที่เหมาะสมจะสามารถนำไปใช้ประโยชน์ในชีวิตประจำวันได้